H2SO4 là gì?Tính chất - Lưu ý khi sử dụng Axit Sunfuric
H2SO4 hay Axit Sunfuric là hóa chất được sử dụng phổ biến hàng đầu, được mệnh danh là "king of chemicals". Tuy nhiên, có rất nhiều bạn đọc chưa hiểu rõ về cấu trúc phân tử của H2 SO4 như thế nào, tính chất lý hóa ra sao, điều chế bằng cách gì? Có cần lưu ý gì khi sử dụng và bảo quản để đảm bảo an toàn không? Cùng Union tìm hiểu nhé!
H2SO4 (Axit Sunfuric) là gì?
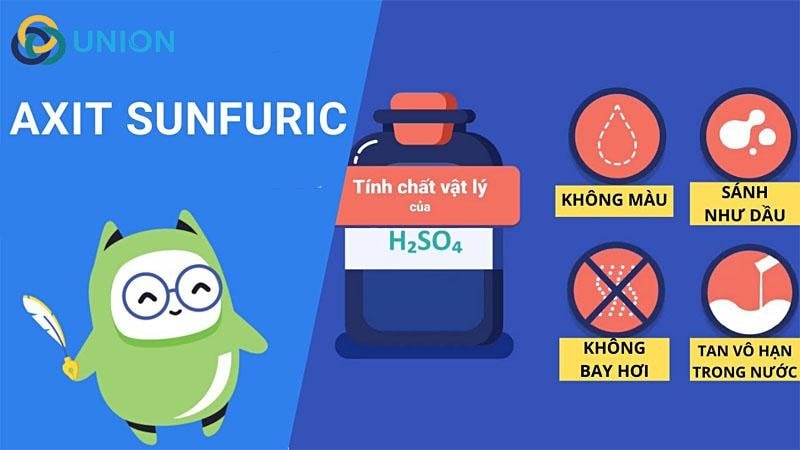
Axit Sunfuric là tên gọi chính của hóa chất H2SO4, tên gọi này được bắt nguồn từ tiếng Pháp là acide sulfurique. Axit Sulfuric là một axit vô cơ gồm các nguyên tố lưu huỳnh, oxy, hidro. Tồn tại ở dạng chất lỏng sánh như dầu, không mùi, không màu, không bay hơi, nặng gấp 2 lần nước (H2SO4 98% có D = 1,84g/cm3). H2SO4 có khả năng tan hoàn toàn trong nước theo bất kể tỷ lệ nào, khi tan trong nước Axit Sulfuric tỏa rất nhiều nhiệt. (Theo Wikipedia)
Trên thế giới, không tìm thấy được H2SO4 nguyên chất tinh khiết, bởi áp lực rất lớn giữa nước và axit sunfuric. Ngoài ra, hợp chất H2SO4 còn là thành phần của mưa axit, nguyên nhân là do sự gia tăng SO2 và NO2 trong khí quyển, trong quá trình mưa, dưới tác dụng của bức xạ môi trường, các oxit này sẽ tác dụng với hơi nước trong khí quyển để hình thành Axit H2SO4 và một số axit khác như (Axit nitric, Axit sunfuro) gây lên hiện tượng mưa axit.
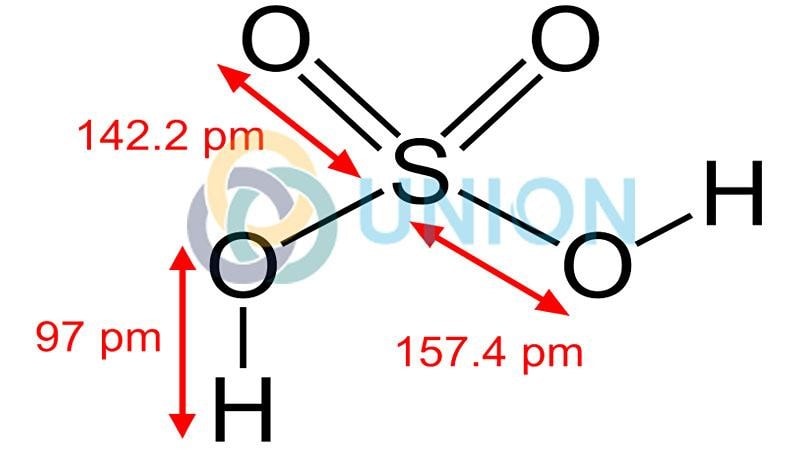
Axit Sunfuric có công thức phần tử là H2SO4.
Cấu trúc phân tử H2SO4
Tính chất của Axit sunfuric (H2SO4)
1. Tính chất vật lý
- H2SO4 là chất lỏng không màu, dạng sánh hơi nhớt, nặng hơn nước, khó bay hơi, tan vô hạn trong nước.
- H2SO4 đặc hút mạnh nước và tỏa rất nhiều nhiệt, do đó trong quá trình pha loãng, nên đổ axit từ từ vào nước (không làm ngược lại), bởi H2SO4 sẽ gây bỏng.
- H2SO4 có thể làm than hóa các hợp chất hữu cơ.
2. Tính chất hóa học
a. Đối với Axit sunfuric loãng
H2SO4 là một axit mạnh, kể cả với nồng độ loãng thì hóa chất này cũng mang đầy đủ tính chất hóa học của một axit như:
- Axit Sunfuric làm chuyển màu quỳ tím thành đỏ
- H2SO4 phản ứng với các kim loại đứng trước Hidro (trừ Pb) tạo muối sunfat
Phương trình hóa học minh họa:
2Al + 3H2SO4loãng → Al2(SO4)3 + 3H2↑
H2SO4 phản ứng với oxit bazơ tạo muối mới (trong muối kim loại giữ nguyên giá trị) và nước. Phương trình hóa học minh họa:
AlO + H2SO4loãng → AlSO4 + H2O
H2SO4 phản ứng với bazo tạo nước và muối mới. Phương trình hóa học minh họa:
NaOH + H2SO4loãng → NaHSO4 + H2O
2NaOH + H2SO4 → Na2SO4
H2SO4 phản ứng với muối tạo muối mới và axit mới. Phương trình hóa học minh họa:
Na2CO3 +H2SO4loãng → Na2SO4 + H2O + CO2
b. Đối với Axit sunfuric đặc
H2SO4 đặc là hợp chất có axit và oxi hóa rất mạnh. Được chứng minh qua các thí nghiệm sau:
Thí nghiệm tác dụng với kim loại: Cho Axit Sulfuric đặc tác dụng với mảnh kim loại Cu tạo dung dịch màu xanh và có khí bay ra, có mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Thí nghiệm tác dụng với phi kim: Cho H2SO4 đặc tác dụng với nguyên tố phi kim như Cacbon (C) và Lưu Huỳnh (S) tạo thành oxit phi kim và nước, giải phóng khí SO2
S + 2H2SO4 → 3SO2↑ + 2H2O
C + 2H2SO4 → CO2 + 2H2O + 2SO2↑
Axit Sulfuric tác dụng với các chất khử khác: Cho H2SO4 tác dụng với chất khử (FeO, FeSO4) tạo thành muối và nước, giải phóng khí SO2
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 4H2O
2FeSO4 + 2H2SO4 → Fe2(SO4)3 + SO2↑ + 2H2O
Thí nghiệm tính háo nước của Axit Sunfuric: Cho H2SO4 vào cốc đựng đường, sau phản ứng đường trong cốc chuyển màu đen và sôi trào
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
Axit sunfuric tồn tại ở mấy dạng?
Tùy vào mục đích sử dụng mà hợp chất Axit Sunfuric tồn tại ở nhiều dạng khác nhau. Cụ thể như:
- Nồng độ 98% là tồn tại ở dạng axit đậm đặc
- H2SO4 loãng sử dụng trong phòng thí nghiệm thường chỉ có 10%.
- Axit sunfuric sử dụng cho ắc quy có nồng độ khoảng 33,5%
- Nồng độ 77,67% được dùng trong tháp sản xuất hay axit glover
- Hàm lượng 62,18% là axit được dùng để sản xuất phân bón
Điều chế Axit sulfuric (H2SO4)
Hiện nay có rất nhiều biện pháp điều chế axit Sunfuric. Dưới đây là phương pháp thông dụng nhất, mời bạn đọc tham khảo.
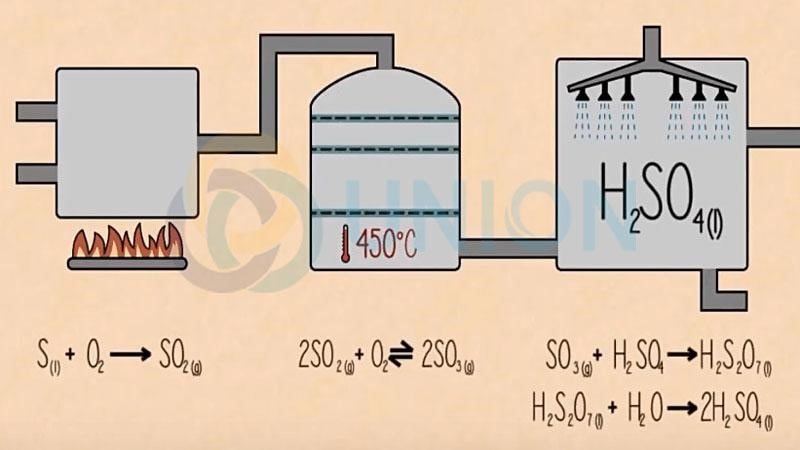
Toàn bộ quá trình điều chế được khái quát bằng: FeS2 hoặc S → SO2 → SO3 → H2SO4
Cụ thể các bước như sau:
Bước 1: Đốt cháy quặng pirit sắt:
4FeS2 + 11O2 → 8SO2 + 2Fe2O3
Bước 2: Oxi hóa SO2 bằng oxi trong điều kiện 400 – 5000C, xúc tác V2O5:
2SO2 + O2 → 8SO3
Bước 3: Axit sunfuric đặc + SO3 tạo thành oleum có công thức tổng quát là
H2SO4.nSO3: nSO3 + H2SO4 → H2SO4 .nSO3
Bước 4: Pha loãng oleum thành axit sunfuric bằng lượng nước thích hợp
H2SO4 .nSO3 + (n+1) H2O→ (n+1)H2SO4
Ứng dụng của Axit sunfuric trong đời sống
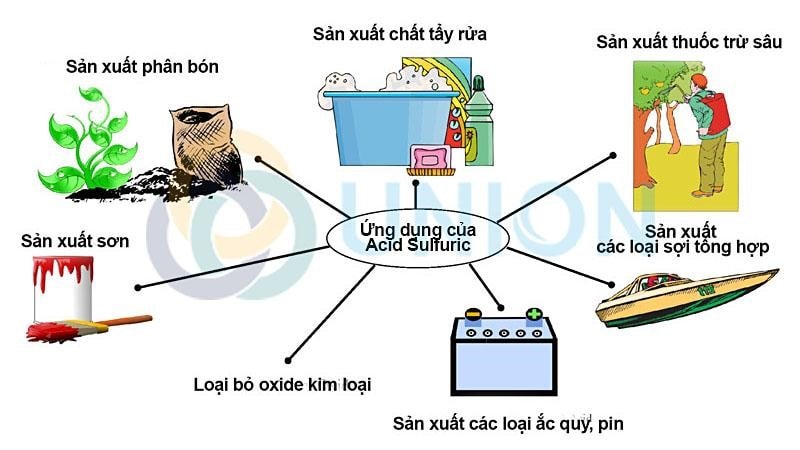
#1. Trong xử lý nước thải
Axit Sunfuric là hợp chất để sản xuất nhôm hidroxit. Chất hydroxit này được dùng trong các nhà máy xử lý nước thải. Nhằm loại bỏ các tạp chất, cải thiện mùi vị trong nước, cân bằng pH và phá tan các ion Mg2+, Ca2+ có trong nước thải.
Lưu ý quan trọng: Axit sunfuric là hóa chất rất nguy hiểm, có thể ăn mòn gây bỏng rộp da. Trước khi sử dụng, người dùng cần phải mặc đầy đủ đồ bảo hộ mặt nạ, quần áo, găng tay, khẩu trang,….
#2. Sản xuất hóa chất
Được biết đến là một hóa chất có tính ứng dụng cao. Axit Sunfuric được sử dụng phổ biến trong quá trình sản xuất một số axit quan trọng như: axit photphoricaxit, hydrochloric, axit nitric và nhiều hóa chất công nghiệp khác.
#3. Trong sản xuất công nghiệp
Theo thống kê, mỗi năm sử dụng hết khoảng 160tr tấn H2SO4. Đặc biệt được sử dụng nhiều trong các ngành công nghiệp như luyện kim, chất dẻo, giấy, sợi,…
- Ứng dụng rộng rãi trong quá trình sản xuất kim loại kẽm, đồng, làm sạch bề thép, dụng dịch tẩy gỉ.
- Ứng dụng trong sản xuất nhôm sunfat, muối sunfat, chất tẩy rửa kim loại, chế tao thuốc nhuộm, chất dẻo, thuốc nổ và dược phẩm.
- H2SO4 kết hợp với nước dùng làm chất điện giải trong ắc quy, axit chì,…
#4. Trong sản xuất phân bón
Một số tài liệu đã kê khai 60% sản lượng axit sunfuric toàn thể giới được ứng dụng trong quá trình sản xuất axit photphoric. Đây là hợp chất để sản xuất phân photphat, amoni photphat, canxi dihydrogen photphat, amoni sunfat.
#5. Trong phòng thí nghiệm
H2SO4 là hợp chất đậm đặc chuyên dùng để điều chế các axit khác yếu hơn như HNO3, HCl trong thí nghiệm.
Tính dẫn điện và tính phân cực của axit sulfuric
Axit Sunfuric khan là hợp chất lỏng phân cực. Hằng số điện môi khoảng 100. Chứng tỏ rằng, hợp chất có thể phân lý bằng cách tự proton hóa chính nó, đây là quá trình tự proton hóa.
2H2SO4 → H3SO4+ + HSO4−
Những lưu ý khi sử dụng và bảo quản axit sunfuric
1. Lưu ý khi sử dụng H2SO4
Sau khi tìm hiểu các tính chất lý hóa của Axit Sulfuric ở phần trên, chắc hẳn bạn đọc cũng nắm được hóa chất này nguy hiểm như thế nào nếu tiếp xúc trực tiếp hay không may bị bắn vào người rồi chứ. Do đó, khi sử dụng cần tuân thủ tuyệt đối các lưu ý dưới đây để đảm bảo an toàn cho bản thân:
- Đeo găng tay dày dặn, đạt chuẩn.
- Mặc đầy đủ quần áo bảo hộ khi tiếp xúc với hóa chất.
- Khi sử dụng đeo kính và mũ đầy đủ.
- Không đi dép hay chân đất nên đi giày bảo hộ hoặc ủng.
- Tuyệt đối không xử lý nó trên một băng ghế mở.
- Tuyệt đối không đổ nó khỏi chai chứa.
- Tuyệt đối không pipette ra với miệng.
- Phải dùng pipet thủy tinh dày với nút cao su.
- Tuân theo đúng chỉ dẫn trên nhãn sản phẩm.
- Tuyệt đối không đổ nước thẳng vào chai chứa để tẩy rửa.
- Khi pha loãng H2SO4, tuyệt đối không được đổ nước vào axit mà cần đổ từ từ axit vào nước.
- Khi đun nóng H2SO4 sẽ giải phóng ra chất SO2 và SO3, đây là những loại khí rất độc hại, có thể cần trang bị mặt nạ phòng độc nếu đun nóng axit với số lượng lớn.
2. Lưu ý khi bảo quản
Tránh việc hóa chất axit sulfuric không may bị rò rỉ xa môi trường, phản ứng với chất khác gây nguy hiểm, ô nhiễm thì khi bảo quản cần phải lưu ý điều sau:
- Lưu trữ axit bằng bồn nhựa, phuy nhựa.
- Không dùng các thùng kim loại để đựng, bởi tính axit mạnh sẽ làm oxy hóa ăn mòn kim loại.
- Đậy nắp thật kín đáo, để nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp.
- Không để gần nơi chứa bazơ hay chất khử.
- Tránh bảo quản chung với các kim loại nặng, kim loại nhẹ, các chất có tính axit như HCl, Axit Nitric gây cháy nổ, rất nguy hiểm.

Axit sunfuric mua ở đâu chất lượng?
Như chúng ta đã biết, H2SO4 là hóa chất được sử dụng nhiều nhất trên thế giới, do đó có rất nhiều đơn vị cung cấp loại hóa chất này. Tuy nhiên, quý khách hàng cần lựa chọn đơn vị phân phối uy tín, tránh mua phải hóa chất kém chất lượng hay lẫn tạp chất sẽ gây nguy hiểm khi sử dụng.
Công ty cổ phần Union là đơn vị có trên 5 năm kinh nghiệm vễ linh vực cung cấp các loại hóa chất bể bơi nói chung và hóa chất Axit Sulfuric nói riêng. Toàn bộ sản phẩm chúng tôi phân phối đều có giấy tờ chứng minh nguồn gốc xuất xứ rõ ràng. Ngoài ra, với hệ thống kho bãi rộng rãi, đảm bảo hóa chất sẽ không lẫn bất kỳ tạp chất nào vì thế chất lượng luôn được đảm bảo, không gây nguy hiểm trong quá trình sử dụng.
Để biết thêm thông tin chi tiết về H2SO4 – Axit Sunfuric hay cần mua hàng xin vui lòng liên hệ hotline 0902.566.498.